Clostridium cellulovorans

C. cellulovoransは嫌気性中温菌であり,カリフォ ルニア大学のDoiらによってセルロソームや分泌型の酵素であるノンセルロソームに関する研究がこれまで行われてきた.
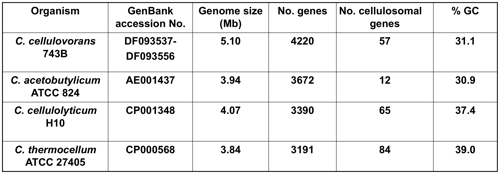
三重大学,京都大学のグループは、嫌気条件下でC. cellulovoransを培養し,ゲノムDNAを抽出した.さらに,Roche Genome Sequencer FLX454およびIllumina Genome Analyzer IIを用いて,全ゲノムシークエンスを行った.最終的に,601コンティグを含む30個のスキャフォールドにアッセンブリングでき,全ゲノム長はおよそ5.1Mbpであることが明らかになった.さらに,CRITICAおよびGlimmer2による遺伝子予測を行ったところ,全遺伝子数は4220遺伝子あるいは4297遺伝子とそれぞれ推定された.興味深いことに,C. cellulovoransセルロソームに関係する遺伝子の総数は,すでにゲノム解析が完了しているC. cellulolyticumおよびC. thermocellumのゲノムと比べて最も少ないことが判明した(表1).
表1 セルロソーム生産性Clostridium属のゲノムの比較
セルロソーム生産性Clostridium属は注目されているが,アセトン・ブタノール・エタノール(ABE)発酵におけるClostridium属の歴史はさらに長い.C. acetobutylicumを使ったABE発酵は,酵母を使ったエタノール発酵に続いて実用化された発酵技術であり,第二次世界大戦まで日本でも行われていた.一方,ゲノム解析については,2001年にマサチューセッツにあるGenome Therapeutics社によってゲノム解読が完了されている.さらに,米国エネルギー省のJoint Genome Institute(JGI)では,2002年からゲノムの相互作用からエコシステムの変化まで,あらゆるレベルの知識の統合体を構築するという微生物を利用した国内のエネルギー需要に画期的な解決法の開発を目指すGTL(Genomes to Life)プログラムに取り組んでいる.またイリノイ大学のBlaschek らは,高ブタノール生産菌であるC. beijerinckiiのゲノム解読をJGIの支援によって完了している.さらに,マサチューセッツ大学のLeschineらは,糖化-エタノール発酵が可能なC. phytofermentansに注目し,同じくJGIの支援によって本菌のゲノム解読を完了している.
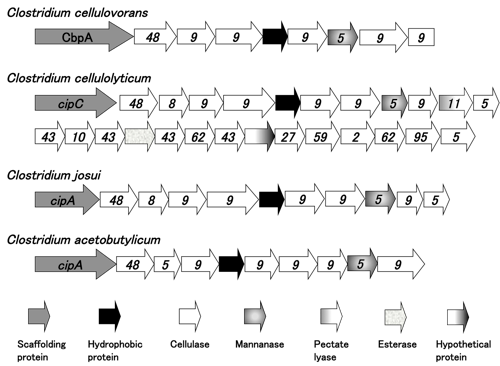
セルロソーム生産性Clostridium属のゲノム解析では,中温菌であるC. cellulovoransに22kb以上にもおよぶセルロソーマルな(セルロソームを構成することのできる)遺伝子クラスターが発見された.さらに,上述で示したように当研究グループは,2009年に本菌のゲノム解読を完了した.C. cellulovoransと同じ中温菌であるC. cellulolyticumのゲノム情報もJGIによってゲノム情報が解読され,cipCを含むセルロソーマルな遺伝子クラスターが見つかっており,中温菌であるC. josuiにもセルロソーマルな遺伝子クラスターが見つかっている.さらに興味深いことに,上述の中温菌であるC. acetobutylicumは,セルロソーム生産菌ではないが,偽遺伝子としてcipAが存在している.これらはいずれもセルロソーム生産性Clostridium属に共通して保存された中温菌由来の遺伝子クラスターであり(図1),セルロソーマルな酵素の組み合わせを探ることで効率的なバイオマス分解の戦略を導き出せそうである.また一方,セルロソーム生産性高温菌であるC. thermocellum ATCC 27405は,JGIによってゲノム情報が完全解読されたが,中温菌のClostridium属に見られるセルロソーマルな遺伝子クラスターはゲノム中に存在しなかった.
Clostridium属のゲノム解析

図1 バイオマス利用に関連する中温性Clostridium属のセルロソーム遺伝子クラスター 矢印内の番号は,CAYzのファミリーナンバーを示す.
一般的にソフトバイオマスはハードバイオマスよりもリグニンの含有量が少ないため酵素による反応が促進されやすい.ヘミセルロースはセルロースに比べ様々な種類があるため,ヘミセルロースを糖化するには多種多様なヘミセルラーゼが必要である.ソフトバイオマスを完全分解し,発酵微生物を使ってアルコールや酸などに変換する“バイオリファイナリー”を効率よく行うためには,C6糖からなるセルロース,C5,C6糖からなるヘミセルロースをグルコース,ガラクトース,キシロースなどの単糖にまで分解する必要がある.
セルロソーム生産性Clostridium属は,セルロソームのみならず,分泌型の酵素“ノンセルロソーム”も生産する.また,バイオマスに応じてセルロソーマルな酵素の組み合わせやノンセルロソーマルな酵素の分泌が異なる.C. cellulovoransのセルロソーム,ノンセルロソームおよびノンセルロソーマルなリコンビナントβ-グルカングルコヒドロラーゼを調製し,不溶性のセルロースに対して単独あるいはそれらを組み合わせたときの酵素活性を調べたところ,セルロソームとノンセルロソームを組み合わせたときに最も高い酵素活性を示した.その活性は,セルロソームあるいはノンセルロソームを単独で作用させたときの合計よりも2.2倍もの相乗効果が見られ,セルロソームとリコンビナントβ-グルカングルコヒドロラーゼを組み合わせたときよりも1.3倍の相乗効果が見られた.また,ノンセルロソーマルな酵素同士だと相乗効果は見られないことから,セルロソームとノンセルロソームを組み合わせることでセルロースを効率よく分解することが証明された.
植物の培養細胞に含まれる細胞壁多糖は,天然のソフトバイオマスと同様に,主にセルロース,ヘミセルロースで構成されており,通常,これらの培養細胞から植物細胞壁のないプロトプラストを調製するには,セルラーゼ,ヘミセルラーゼ,ペクチナーゼなどの複数の酵素製剤を用いる必要がある.驚くべきことに,タバコやシロイヌナズナの培養細胞にC. cellulovoransのセルロソームとノンセルロソームで処理するとプロトプラストを調製することができる(図2).さらに,炭素源にグルコース,セロビオース,キシラン,ローカストビーンガムでC. cellulovoransを培養し,生産されたセルロソーム,ノンセルロソームを調べたところ,どの炭素源においてもカルボキシメチルセルロース分解酵素(CMCase),キシラナーゼ,マンナナーゼ,ペクチンリアーゼなどの酵素活性が見られたが,ローカストビーンガムで培養したものにはセルロソームの発現が確認されなかった.さらに,各炭素源におけるセルロソーム、ノンセルロソームを用いて植物培養細胞からのプロトプラスト形成能の有無を確認したところ,ローカストビーンガムで培養したものだけがプロトプラストを形成することができなかったことから,植物細胞壁の分解にはセルロソームが必須であることがわかった.実バイオマスに関しては,稲わらなどのソフトバイオマスを炭素源として培養すると菌体量が増大し,直接分解される.これらの結果から,C. cellulovoransのセルロソーム,ノンセルロソームを詳細に調べることで,ソフトバイオマスを完全糖化するヒントを見つけることができるだろう.
セルロソームおよびノンセルロソームの相乗効果
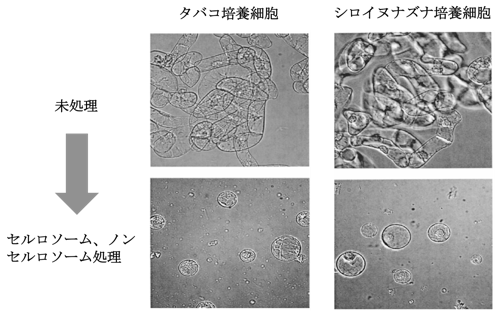
図2 C. cellulovoransのセルロソーム,ノンセルロソームを用いた植物培養細胞からのプロトプラストの作出
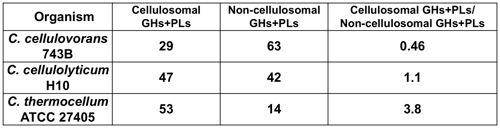
植物細胞壁を効率よく分解するにはセルロソーム,ノンセルロソームの両方の酵素成分が必要である.上述のゲノム解析が完了しているC. cellulovorans,C. cellulolyticum,C. thermocellumのKEGGパスウェイ解析を行い,代謝に関連する酵素を全て導き,それ以外にゲノム中に含まれるセルロース系バイオマスを分解するのに必要な糖質加水分解酵素と多糖リアーゼの総数を調べた.その結果,C. cellulovoransは,セルロソーマルな糖質加水分解酵素と多糖リアーゼの合計は29個と一番少なかったが,ノンセルロソームな糖質加水分解酵素と多糖リアーゼの合計は63個と最も多く,C. thermocellumの約4倍近くあった.そして,それらの多くがヘミセルラーゼであった(表2).ゲノム情報から推測できることは,C. cellulovoransは多種多数な分泌型のノンセルロソームを使ってバイオマスに含まれるヘミセルロースを分解し,内部に埋もれているセルロースを露出させて効率的に分解しているようである.さらに,セルロソーム関連遺伝子については,CbpAのようなセルロソーマルな酵素が9つ結合可能な骨格タンパク質以外にも,セルロソーマルな酵素を1つ結合できるHbpA,さらに新規な遺伝子であり,HbpAと同じくセルロソーマルな酵素が1つ結合可能なCbpB,CbpCの合計4種類が明らかになった(図3).なお,CbpAに関しては,バイオマスに応じて他のClostridum属よりも少ない組み合わせからなるセルロソーマルな酵素群を構築し,これら大小異なるセルロソームを使って露出したセルロースを効率よく分解すると推測できる.
GHs: Glycoside hydrolases PLs: Polysaccharide Lyases
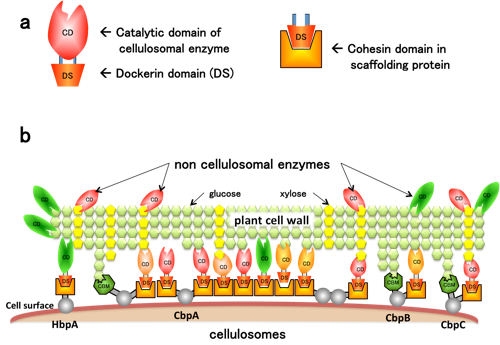
図4 C. cellulovoransのソフトバイオマス分解の戦略
a: バイオマスに応じて,触媒ドメインを持つセルロソーマルな酵素を発現する.
b: 細胞表層に大小異なる4種類のセルロソーム(HbpA, CbpA, CbpB, CbpC)を発現させ,バイオマスに応じてセルロソーム,ノンセルロソーマルな酵素を組み合わせることによって糖化の効率を上げると予想される.
セルロース系バイオマスの組成は植物の種類やその部位ごとに千差万別であるが,C. cellulovoransは,その組成を察知して様々な組み合わせからセルロソームを構築しノンセルロソームを分泌している. そのため,各種バイオマスに対して分泌されるセルロソームやノンセルロソームの構成成分の解析が重要であり,トランスクリプトオーム解析やプロテオーム解析によりどのようなセルロソーム,ノンセルロソームが発現しているかを定量的に解析する必要がある.これらはすべてゲノム情報,すなわち細胞の設計図に直ちに立ち戻ることができるため,各種バイオマスに対して実際にどのようなセルロソームやノンセルロソームの構成成分が必要であるかをC. cellulovoransから学ぶことができる.さらに,バイオマス由来の植物細胞壁多糖の分解にセルロソームが必須であることから,発現量の多い酵母を用いた細胞表層工学や嫌気性菌発現系を活用した組換え微生物などを使ってバイオマスに適したセルロソームが必要になると考えられる.各種バイオマスに適した“デザイナブルセルロソーム”を構築することで,最終的にはバイオマス前処理・糖化に微生物そのものを活用する“微生物前処理糖化法”への応用が期待される.
ゲノム情報を活用した研究戦略
copyright (c) 2004-2011 Miyake's HP All rights reserved.
表2 セルロソーム生産性Clostridium属が生産する糖質関連酵素数の比較
C. cellulovoransのゲノム解析

C. cellulovoransのソフトバイオマス分解の戦略



<文献>
Tamaru, Y., Miyake, H., Kuroda, K., Nakanishi, A., Matsushima, C., Doi, R. H., Ueda, M. “Comparison of the mesophilic cellulosome-producing Clostridium cellulovorans genome with other cellulosome-related clostridial genomes.” Microbial. Biotechnology., in press
植田充美, 黒田浩一, 三宅英雄, 田丸浩. “ソフトバイオマス完全糖化の新バイオ技術” 配管技術(日本工業出版), 52(7), 1-6. (2010)
植田充美, 黒田浩一, 三宅英雄, 田丸浩. “バイオマスを完全分解・糖化する革新的微生物前処理技術に向けて” ブレインテクノニュース(農研), 139, 20-27. (2010)
Tamaru, Y., Miyake, H., Kuroda, K., Ueda, M., Doi, R. H. “Comparative genomics of the mesophilic cellulosome-producing Clostridium cellulovorans and its application to biofuel production via consolidated bioprocessing.” Environ. Technol., 31(8-9), 889-903. (2010)
三宅英雄, 田丸浩 “ソフトバイオマス完全糖化を目指した デザイナブルセルロソームの構築” 生物工学会誌, 88(7), 336-339. (2010)
Tamaru, Y., Miyake, H., Kuroda, K., Nakanishi, A., Kawade, Y., Yamamoto, K., Uemura, M., Fujita, Y., Doi, R. H., Ueda, M. “Genome sequence of the cellulosome-producing mesophilic organism Clostridium cellulovorans 743B.” J. Bacteriol., 192(3), 901-902. (2010)