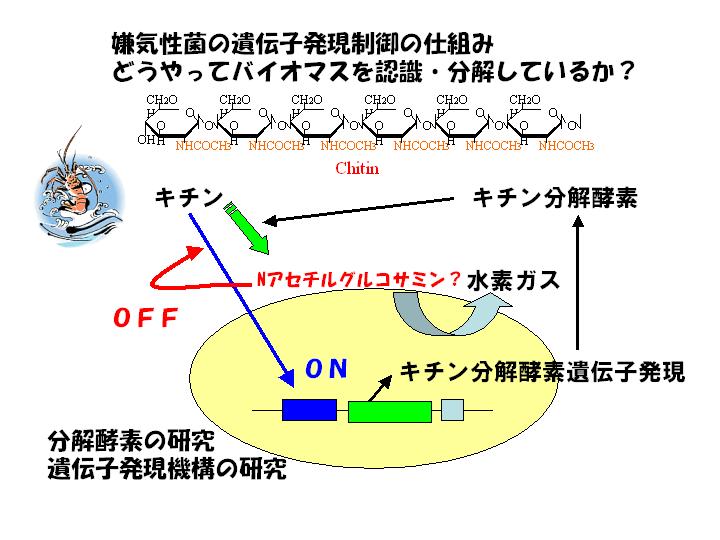
嫌気性菌Clostridium paraputrificum M21株は、キチンを効率よく分解し水素ガスを生産します。このキチン分解のための酵素は、キチンよりも分解しやすい糖が存在すると生産されません。今までの研究からキチン分解酵素の転写レベルでの制御が存在することがわかっています。しかし、その制御に関しては不明なままです。バクテリアの遺伝子発現制御に関しては、有名なラクトースオペロン以来多くの研究がなされています。しかし、嫌気性菌は遺伝子工学的に扱いずらいため遺伝子の発現制御に関してはあまり研究が進んでいません。そこで、形質転換が可能なC.
paraputrificumをモデルとして嫌気性菌の遺伝子発現に関するメカニズムを解明し、究極的には嫌気性菌を宿主にした効率的な酵素生産システムを構築することを目指しています。
Characterization of the Third Chitinase
Chi18C of Clostridium paraputrificum
M-21, K. Morimoto et al., Appl. Microbiol. Biotechnol..(2007)
Identification of a catalytic residue of Clostridium paraputrificum
N-acetyl-b-D-glucosaminidase Nag3A by
site-directed mutagenesis,
H. Li et al., Biosci. Biotechnol. Biochem., 70(5), 1127-1133 (2006).
Electrotransformation of Clostridium
paraputrificum M-21 with some
plasmids, K. Sakka et al., J. Biosci. Bioeng., 96 (3), 304-306 (2003)
A new type ofb-N-acetylglucosaminidase from
hydrogen-producing Clostridium
paraputrificum
M-21,H. Li et al., J. Biosci.
Bioeng., 96(3), 268-274 (2003).
A novelb-N-acetylglucosaminidase of Clostridium paraputrificum M-21 with high activity on chitobiose, H. Li et al., Appl. Microbiol. Biotechnol., 60, 420-427 (2002).
Characterization of Clostridium
paraputrificum chitinase A from a recombinant
Escherichia coli, K. Morimoto et al., J. Biosci. Bioeng., 92 (5), 466-468 (2001).
Seqencing, expression, and transcription analysis of the Clostridium paraputrificum chiA gene
encoding chitinase ChiA. K. Morimito et al., Appl. Microbiol. Biotechnol.,51:340-347.(1999)
Cloning, sequencing, and expression of the gene encoding Clostridium paraputrificum chitinase chiB and analysis of the function of novel cadherin-like domains and a chitin-binding domain. K. Morimoto et al., J. Bacteriol., 179(23), 7306-7314 (1997)