セルラーゼのモジュールのひとつにセルロース結合モジュールがあります。80年代後半、セルラーゼをプロテアーゼで処理すると、可溶性セルロースに対する活性は減少しないのに、結晶性セルロースに対する活性が激減してしまうところから、このモジュールの存在が明らかになりました。このプロテアーゼで切断されるところには、比較的にプロリン、スレオニン、セリンなどが多いことから、PT-ボックスなどと呼ばれたこともありましたが、現在では、モジュール間をつないでいるところということで、リンカー(linker)と呼んでいます。セルロースやヘミセルロースは基本的に、水に不溶性なので、水に溶けている酵素にとっては、なかなか基質と出会う機会がありません。そこで、基質に結合するためのモジュールをもったと考えられます。セルロースはグルコースのユニットから構成されていますので、結合モジュールには、糖-蛋白質の相互作用が必要とされます。これらのモジュールについても触媒モジュールのファミリーのように、「糖質結合モジュール」としてアミノ酸配列の相同性から50を超えるファミリーに分類されています。当初、触媒モジュールのファミリーとの混同をさけるため、ローマ数字をファミリーに使っていました(CBM VIといった具合)。現在では、触媒のほうは、GH9、結合モジュールは、CBM6といって具合に両方とも数字で表します。タンパク質構造的には、β-バレル構造が多く、糖との結合には、芳香族アミノ酸(トリプトファンやチロシンなど)が関与しているといわれています(糖との疎水性によるスタッキング効果)。結晶性のセルロースに結合するモジュールは、結合面がフラットな構造になり、そこに芳香族アミノ酸が並んでいるという特徴があります(下図、CBM1など)。一方、非結晶性セルロースやキシランに結合するモジュールでは、結合面はややくぼんだクレフト(溝)を形成しており、そこに、芳香族アミノ酸が露出しています(下図、CBM6など)。また糖鎖の端に結合するモジュールでは、クレフトが、突き当たりになており、そこを二つの芳香族アミノ酸ではさんでいるというような構造になっています(CBM9など)。
これらのモジュールは基本的には、触媒モジュールとリンカーで隔てられており、機能としては独立しています。すなわち、リンカー部分で切断して、別々のタンパク質としても、触媒は触媒、CBMはCBMとしての機能を維持しています。しかし、全てがそうだというわけではなく、GH9のセルラーゼでは、触媒のクレフトと結合モジュールのクレフトが一列にならび、結合モジュールが結合したセルロース鎖を直接触媒のクレフトへ誘導すると推定されるような構造が知られています。また、当初結合モジュールを除去しても、水溶性基質に対する活性は、変化しない例が多くありました。ところが結合モジュールの除去により水溶性基質に対する活性までもが極端に減少する、または無くなる例も報告されており、その機能が触媒モジュールと独立していない場合もあると考えられます。また、一部のファミリーの結合モジュールは、それ自身に結晶性セルロースを壊す作用があることも知られています。最近では、これらの結合モジュールを組換え蛋白質のタグとして精製に利用したり、酵素や菌体のセルロースへの固定化や、植物の生育促進剤としてなど応用面でも注目されています。
Borastonらは、結合様式の違いによりCBMを3つのタイプに分けましょうという提案をしています。平らな結合面で結晶性セルロースに結合するタイプA、クレフト(溝)で、非結晶性セルロースにある糖鎖や水溶性糖鎖に結合するタイプB、セルロース鎖の還元末端に結合するタイプCです(Boraston et al., Biochem. J. 382:769-781(2004))。
またいろいろなモジュールの登場でややこしくなってきているので、CBMの表示についても、由来する菌名の属と種の頭文字をとって、例えばClostiridium stercorarium 由来のCBM6でしたら、CsCBM6といったように書きましょうと提案しています。
セルロース結合モジュールを考えるとき、結合は強いほうがいいのか、ゆるいほうがいいのか? 昔、まだセルラーゼのモジュール構造が明らかではなかったころ、「よく結合する酵素は、よく分解する」という法則のようなものがありました。繊維は長いので酵素は、きっと繊維上を移動しなければならないでしょう。そのときに結合モジュールはどうなるのか? 実験的にいくつかのモジュールはセルロ−ス上を移動可能であることが示されています。また、結合と酵素分解には、最適な結合数があり、結合しすぎても酵素の分解効率は落ちるのではないかと考えられています。では、セルロソームのように大きな複合体で、多数の結合モジュールを持つものはどうなるのでしょうか? 結合モジュールファミリー1とセロビオヒドロラーゼの組み合わせでは(たとえば、Trichoderma reesei のCel7A (CBHI)など)、触媒もプロセッシブですし、セルロースの表面を移動するという考えは受け入れやすいと思います。実際に原子間力顕微鏡で東京大学の五十嵐先生が、セルロース繊維上を動く酵素の映像をとらえています。一方、細菌がつくる巨大なセルロソーム、しかも複数のセロビオヒドロラーゼを含み、複数の結合モジュールをもっている、どうやってセルロース表面を移動するのでしょうか?いやいや、きっとセルロソームは移動する必要がないのでしょう。まだまだ、わからないことのほうが多いです。
CBMの結合には、ふたつのタイプがあります。結合により比較的熱の出るエンタルピー駆動型と、熱のでないエントロピー駆動型とがあります。これらは、等温滴定熱量計(Isothermal Titration Calorimetry)による結合パラメータの解析により計算することができます。この二つの様式の違いは、芳香族アミノ酸の糖環とのスタッキングによる疎水性な結合と、それに加わる親水性アミノ酸側鎖による糖環の水酸基との水素結合の寄与により現れると考えられています。また、結晶構造やNMRで解かれた構造だけでなく、大型コンピュータを使ったCBM結合のシュミレーションでは、糖と芳香族アミノ酸との結合により、CBMの構造に変化がおき、静止構造では考えることのできない相互作用があることもわかってきました。
最近、非結晶性セルロース結合性CBMのなかでも、セルロース上で異なる領域を認識している証拠がでてきました。つまり、非結晶性セルロースとひとくちにいっても、我々は知らないがCBMは区別できる構造の差異のある領域が存在しているのです。また結晶性結合CBMでも、似たようなことがあります。このように考えると、カビのセルラーゼがもつCBMと細菌のセルラーゼがもつCBMの特性の違いは、対象としているセルロースの質の違いにあるような気もしてきます。セルロースを分解する触媒モジュールの多様性とCBMの多様性、この二つを理解していけば、草を完全に糖化できるような酵素の配合を知ることができるのではないでしょうか。
セルロースをはじめとする炭水化物に結合するモジュールファミリーの最新データは、ここをクリックしてください。触媒ファミリー同様にCNRSのデータベースCAZyにつながります。
以下の図は、RasMol(Ver. 2.7.2.1)とPyMOLを用いて作成しました。

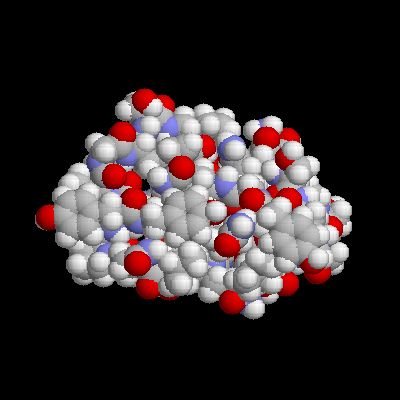
結晶性セルロースへ結合するファミリー1のCBMのセルロース結合面をスペースフィルモデルでみたところです。結合に関与する3つのチロシン残基のベンゼン環が1列に並んでいる様子がわかると思います。この3つの芳香族とセルロース鎖上のグルコース環との疎水的な相互作用が、セルロースへの結合に重要であると考えられています。このようにセルロースとの結合面がフラットになっている構造をもつものをタイプAのCBMといいます。(Trichoderma reesei 由来セロビオヒドロラーゼIのCBM1、PDB 1CBH)
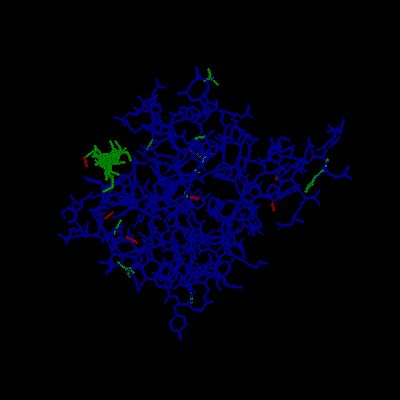
非結晶性セルロースに結合するファミリー29のCBMの場合、結合は、クレフトと呼ばれるくぼみで起こります。左の図では、青い部分がCBM本体のアミノ酸で、緑の部分が結合しているオリゴ糖です。この場合の結合に関係する芳香族アミノ酸は、このクレフト内部にあります。これが、結晶性セルロースと非結晶性セルロースへ結合するモジュールの大きな差異です。(CBM29、PDB 1GWL)
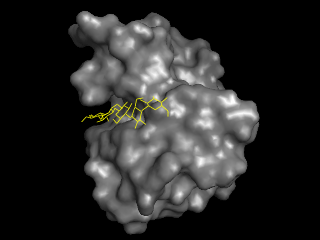
非結晶性セルロースに結合するファミリー4のCBM、クレフトの構造がよくわかります。このような結合部位の構造をもったものをタイプBのCBMといいます。
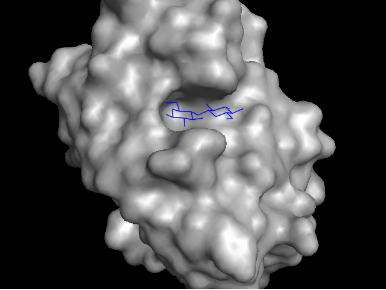
セルロース鎖の還元末端に結合するファミリー9のCBM。この場合は結合部位は穴状の構造をもっており、セルロース鎖の還元末端側が、どんつきに当たっています。二番目のグルコースの位置で、二つのトリプトファン残基がはさんだ形で結合しています。このような結合部位の構造をタイプCのCBMといいます。